migor
By busukx.blogspot.com at November 29, 2023
migor
Proses yang dipakai pada penelitian kali ini merupakan proses secara kimia yaitu
saponifikasi. Dengan tujuan untuk melihat pengaruh dari kecepatan pengadukan,
konsentrasi dan perbandingan penggunaan alkali terhadap sabun yang dihasilkan.
Sebelum dipakai untuk membuat sabun, dilakukan proses pemurnian terlebih
dahulu terhadap minyak ini . Hal ini bertujuan agar warna minyak menjadi lebih
jernih. Pada proses pembuatan sabun, dipakai 2 jenis alkali yang berbeda. Yaitu NaOH
dan KOH. Variable yang dipakai dalam penelitian ini yaitukecepatan pengadukan dan
konsentrasi alkali yang dipakai. Kecepatan pengadukannyayaitu 500 rpm, 550 rpm, 600
rpm, 650 rpm dan 700 rpm. Sedangkan konsentrasi alkali yang dipakai yaitu 20%, 25%
dan 30%. Bahan baku yang dipakai dalam penelitian ini yaitu minyak jelantah dari sisa
limbah rumah tangga, berupa penggorengan kerupuk. Sebelum dipakai untuk membuat
sabun, dilakukan proses pemurnian terlebih dahulu terhadap minyak ini dengan
menggunakan absorben yang terbuat dari tempurung kelapa sebanyak 7% dari berat
minyak jelantah yang akan dimurnikan. Hal ini bertujuan agar warna minyak menjadi lebih
jernih. Pada proses pembuatan sabun, dipakai jenis alkali KOH. Variabel yang
dipakai dalam penelitian ini yaitu lama waktu pengadukan dan jumlah alkali yang dipakai. Waktu pengadukannya yaitu 30 menit, 40 menit, dan 50 menit. Jumlah alkali
yang dipakai yaitu 15 ml, 20 ml, 25 ml,dan 30 ml dan yang ditinjau pada penelitian ini
adalah kinetika reaksi kimia yang terjadi pada saponifikasi.
Data penelitian yang diukur yaitu kadar air, alkali bebas, minyak mineral, dan
derajat keasaman (pH). Pengukuran kadar air dilakukan dengan menimbang contoh
sebanyak 4 gram, dengan menggunakan cawan yang telah diketahui beratnya. Contoh
ini dipanaskan dalam lemari pengering pada suhu 105°C selama 2 jam. Pengukuran
alkali bebas dilakukan dengan menggunakan alcohol netral yang telah ditambahkan batu
didih, dan dipasang pendingin tegak, lalu larutan dititrasi dengan menggunakan HCl 0,1 N
hingga warna merah hilang.
Pengukuran kandungan minyak mineral dilakukan dengan metode titrasi
menggunakan larutan HCl 10% dan NaOH 0,5 N. Pengukuran pH dilakukan dengan
menggunakan elektrometer.
Alat
Peralatan yang dipakai meliputi stirer, beker gelas, erlenmeyer, spatula, corong
pemisah, gelas ukur, penangas air, labu ukur, hot plate, titrasi digital, klem dan statif, pipet
tetes, oven, pH meter, timbangan analitik, indikator pp.
Bahan
Bahan baku yang dipakai dalam penelitian ini yaitu minyak jelantah dari sisa
limbah rumah tangga, berupa penggorengan kerupuk. Pada proses pembuatan sabun,
dipakai jenis alkali KOH. Selain itu dipakai juga parfum non alkohol 1 ml, pewarna
makanan, EDTA, NaCl, gliserin.
Minyak goreng termasuk dalam salah satu bahan pangan yang sangat dibutuhkan
oleh masyarakat dalam rangka pemenuhan kebutuhan sehari-hari. Namun, pemakaiannya
tentu ada batasnya. Pemanfaatan minyak goreng baik untuk industri maupun rumah
tangga, menghasilkan minyak bekas yang masih mengandung asam lemak yang cukup
tinggi karena dipakai berulang kali. Hasil suatu penelitian, menujukkan bahwa
penyerapan minyak, kadar asam lemak bebas, dan nilai TBA pada minyak semakin
meningkat hingga penggorengan kelima yang ditunjukkan pada makanan gorengan ayam.
Kerusakan minyak goreng bekas sebanding dengan interval penggorengan. Indikator
kerusakan minyak antara lain angka peroksida dan asam lemak bebas. Asam lemak bebas
menunjukkan sejumlah asam lemak bebas yang dikandung oleh minyak yang rusak,
terutama karena peristiwa oksidasi dan hidrolisis (Sudarmadji, 1982). Adapun standar
mutu minyak goreng di negara kita telah dirumuskan dan ditetapkan oleh Standar Nasional
negara kita 01-3741-2002, menjelaskan bahwa nilai maksimal angka peroksida 1%mg
02/gr, asam lemak bebas 0.3%, kadar air 0.3%, dan arsen 1% b/b. Kerusakan pada minyak
dapat diamati secara visual yaitu timbulnya bau, warna kecoklatan dan rasa tengik yang
disebabkan oleh autooksidasi minyak. Selain itu kandungan asam lemak bebas dalam suatu
minyak merupakan salah satu parameter penentu mutu minyak goreng. Semakin besar
kadar asam lemak bebasnya, maka semakin rendah kualitas minyak goreng ini . Kadar
asam lemak bebas minyak goreng bekas yang dihasilkan dapat menurunkan hingga rasio
10% dengan penggunaan rasio arang aktif yang semakin besar (Nasir dkk, 2014).
Ibu rumah tangga banyak yang menggunakan minyak goreng berulang-ulang.
Mereka sengaja menggunakan minyak goreng bekas ini dengan alasan untuk
berhemat dan adanya anggapan jika menggoreng sesuatu dengan minyak jelantah rasa
yang dihasilkan lebih gurih. Pada proses pemakaian yang berulang kali akan menyisakan
lemak jenuh yang tinggi, asam lemak jenuh yang tinggi dapat menyebabkan terbentuknya
kolesterol. Hal ini banyak di dapat pada penggunaan minyak yang lebih dari dua kali
, minyak yang dipakai untuk proses penggorengan akan
mengalami 4 perubahan besar yang terjadi yaitu:perubahan warna,oksidasi, polimerisasi
dan hidrolisis. Pembentukan flavor yang menyimpang juga sering terjadi pada minyak
yang telah dipakai selama proses penggorengan. Kondisi ini menyebabkan terjadinya
dekomposisi komponen penyusun minyak. Hasil dekomposisi ini mempunyai
pengaruh negatif terhadap kualitas minyak maupun rasa dan nilai gizi hasil gorengannya.
Beberapa komponen hasil dekomposisi minyak ini dapat membahayakan kesehatan
karena menyebabkan kerusakan, terutama pada organ yang terkait dengan metabolisme
minyak (Rukmini, 2007). Kerusakan minyak atau lemak akibat penggunaan secara terus
menerus akan mengakibatkan berbagai macam penyakit, misalnya diare, pengendapan
lemak dalam pembuluh darah, kanker dan menurunkan nilai cerna lemak. Beberapa
penyakit seperti PJK (penyakit jantung koroner), rasa gatal pada tenggorokan,
dislipidemia, obesitas, atheroskerosis, juga disebabkan oleh penggunaan minyak goreng
bekas. Ironisnya, masyarakat negara kita saat ini cenderung menitikberatkan nilai ekonomis
daripada nilai kesehatan yang saat ini lebih cenderung diabaikan (Widayat, 2006).
Menurut data yang dikeluarkan oleh World Health Organization, penyakit
kardiovaskular merupakan penyebab kematian manusia nomor satu di negara maju dan
berkembang dengan menyumbang 30% atau sekitar 17 juta kasus dari seluruh kematian di
dunia. Dari angka ini, diperkirakan 7,3 juta disebabkan oleh penyakit jantung koroner.
Sedangkan data Riset Kesehatan Dasar (Riskesdas) Kementerian Kesehatan Republik
negara kita mengenai Penyakit Tidak Menular tahun 2007 menunjukkan bahwa kematian
akibat penyakit jantung adalah sebesar 7,2% dari total angka kematian akibat penyakit
tidak menular di negara kita ,
Organisasi Stroke Dunia mencatat hampir 85% orang yang mempunyai faktor
resiko dapat terhindar dari stroke bila menyadari dan mengatasi faktor resiko ini sejak
dini. Badan kesehatan dunia memprediksi bahwa kematian akibat stroke akan meningkat
seiring dengan kematian akibat penyakit jantung dan kanker kurang lebih 6 juta pada tahun
2010 menjadi 8 juta di tahun 2030. Di negara kita dinyatakan bahwa penderita stroke
jumlahnya terus meningkat dari tahun ke tahun. Pada tahun 2004 penelitian di sejumlah
rumah sakit menemukan pasien rawat inap karena stroke jumlahnya sekitar 23.000 orang
Di negara kita , tiap tahun diperkirakan ada 100
penderita baru per 100.000 penduduk. Ini berarti dari jumlah 237 juta penduduk, ada
sekitar237.000 penderita kanker baru setiap tahunnya. Sejalan dengan itu, data empiris
juga menunjukkan bahwa kematian akibat kanker dari tahun ke tahun terus meningkat.
Berdasarkan hasil Riskesdas tahun 2007, sekitar 5,7 % kematian semua umur disebabkanoleh kanker ganas di negara kita prevalensi tumor/kanker adalah 4,3 per 1000 penduduk.
Kanker merupakan penyebab kematian nomor 7 (5,7%) setelah stroke, TB, hipertensi,
cedera, perinatal, dan DM (Riskesdas, 2007).
Mengingat banyaknya efek buruk terhadap kesehatan akibat minyak goreng bekas,
diperlukan adanya suatu terobosan baru. Upaya untuk mengolah minyak goreng bekas dalam
rangka penghematan, namun tidak membahayakan kesehatan serta mudah dilakukan sangat
diperlukan. Salah satunya dengan melakukan penelitian pembuatan sabun dari minyak
goreng bekas pakai.
Sabun yang telah berkembang sejak zaman Mesir kuno ini berfungsi sebagai alat
pembersih. Keberadaan sabun yang hanya berfungsi sebagai alat pembersih dirasa kurang,
mengingat pemasaran dan permintaan masyarakat akan nilai lebih dari sabun mandi. Oleh
karena itu, banyak sabun yang beredar di pasaran sekarang ditambahkan dengan berbagai
bahan-bahan aditif yang berfungsi untuk menambah nilai guna sabun itu sendiri.
Sabun adalah salah satu jenis surfaktan yang bisa membersihkan kotoran berminyak
dan menjadi bagian dari kelompok yang disebut surfaktan. Sabun yang dimaksud disini
adalah produk campuran garam natrium dengan asam stearat, palmitat, dan oleat yang berisi
sedikit komponen asam miristat dan laurat. Sabun merupakan kosmetik pembersih paling tua,
sudah sejak berabad abad yang silam.
Sabun merupakan komoditi hasil olahan minyak kelapa sawit yang populer yang
berfungsi sebagai zat yang mampu membersihkan dan mengangkat benda asing. Reaksi yang
terjadi pada saat pembuatan sabun dari minyak kelapa sawit disebut reaksi Saponifikasi.
Saponifikasi dilakukan dengan mereaksikan minyak kelapa sawit (triglisrida) dengan
alkali (biasanya menggunakan NaOH atau KOH) sehingga menghasilkan gliserol dan garam
alkali Na (sabun). Saponifikasi juga dapat dilakukan dengan mereaksikan asam lemak dengan
alkali sehingga menghasilkan sabun dan air. Sabun biasanya berbentuk padatan tercetak yang
disebut batang karena sejarah dan bentuk umumnya. Penggunaan sabun cair juga telah telah
meluas, terutama pada sarana-sarana publik. Jika diterapkan pada suatu permukaan, air
bersabun secara efektif mengikat partikel dalam suspensi mudah dibawa oleh air bersih. Di
negara berkembang, detergen sintetik telah menggantikan sabun sebagai alat bantu mencuci.
Penggunaan sabun dalam kehidupan sehari-hari sudah tidak asing lagi, terutama
sesuai dengan fungsi utamanya yaitu membersihkan. Berbagai jenis sabun ditawarkan dengan
beragam bentuk mulai dari sabun cuci (krim dan bubuk), sabun mandi (padat dan cair), sabun tangan (cair) serta sabun pembersih peralatan rumah tangga (krim dan cair).
Minyak goreng memegang peranan yang sangat penting dalam pengolahan produk
pangan. Hal ini mengakibatkan konsumsi minyak goreng meningkat dari tahun ke tahun.
Konsumenminyak goreng terbesar adalah industri makanan, restoran, dan hotel. Setelah
dipakai berulangulang selanjutnya minyak goreng ini menjadi minyak goreng bekas.
Sebenarnya minyak goreng bekas ini masih dapat dimanfaatkan kembali setelah
dilakukan proses pemurnian ulang (reprosesing), namun karena keamanan pangan
mengkonsumsi minyak goreng hasil reprosesing masih menjadi perdebatan sengit akibat
adanya dugaan senyawa akrolein yang bisa menyebabkan keracunan bagi manusia, maka
alternatif lainnya adalah dengan memanfaatkannya sebagai bahan baku industri non pangan
seperti sabun lunak. Sabun dibuat melalui proses saponifikasi lemak minyak dengan larutan
alkali membebaskan gliserol. Lemak minyak yang dipakai dapat berupa lemak hewani,
minyak nabati, lilin, ataupun minyak ikan laut. Pada saat ini teknologi sabun telah berkembang
pesat. Sabun dengan jenis dan bentuk yang bervariasi dapat diperoleh dengan mudah dipasaran
seperti sabun mandi, sabun cuci baik untuk pakaianmaupun untuk perkakas rumah tangga,
hingga sabun yang dipakai dalam industri. Kandungan zat-zat yang ada pada sabun
juga bervariasi sesuai dengan sifat dan jenis pembuatan abun bergantung pada jenis sabun
ini . Larutan alkali yang biasa yang dipakai pada sabun keras adalah Natrium
Hidroksida (NaOH) dan alkali yang biasa dipakai pada sabun lunak adalah Kalium
Hidroksida (KOH).
Minyak goreng adalah minyak yang berasal dari lemak tumbuhan atau hewan yang
dimurnikan dan berbentuk cair dalam suhu kamar dan biasanya dipakai untuk menggoreng
makanan. Minyak goreng dari tumbuhan biasanya dihasilkan dari tanaman seperti kelapa, bijibijian, kacang-kacangan, jagung, kedelai, dan kanola. Minyak goreng umumnya berasal dari
minyak kelapa sawit.Minyak kelapa dapat dipakai untuk menggoreng karena struktur
minyaknya yang memiliki ikatan rangkap sehingga minyaknya termasuk lemak tak jenuh yang
sifatnya stabil. Selain itu pada minyak kelapa ada asam lemak esensial yang tidak dapat
disintesis oleh tubuh. Asam lemak ini adalah asam palmitat, stearat, oleat, dan linoleat
Minyak Goreng Bekas
Minyak goreng bekas atau yang biasa disebut dengan minyak jelantah adalah minyak
limbah yang bisa berasal dari jenis-jenis minyak goreng seperti halnya minyak jagung, minyak
sayur, minyak samin dan sebagainya, minyak ini merupakan minyak bekas pemakaian
kebutuhan rumah tangga umumnya. Sehubungan dengan banyaknya minyak goreng bekas dari
sisa industri maupun rumah tangga dalam jumlah tinggi dan menyadari adanya bahaya
konsumsi minyak goreng bekas, maka perlu dilakukan upaya-upaya untuk memanfaatkan
minyak goreng bekas ini agar tidak terbuang dan mencemari lingkungan. Pemanfaatan
minyak goreng bekas ini dapat dilakukan pemurnian agar dapat dipakai kembali sebagai
media penggorengan atau dipakai sebagai bahan baku produk berbasis minyak seperti
sabun.
Pemurnian Minyak Goreng Bekas
Pemurnian merupakan tahap pertama dari proses pemanfaatan minyak goreng bekas,
yang hasilnya dapat dipakai sebagai minyak goreng kembali atau sebagai bahan baku
produk untuk pembuatan sabun cair. Tujuan utama pemurnian minyak goreng ini adalah
menghilangkan rasa serta bau yang tidak enak, warna yang kurang menarik dan
memperpanjang daya simpan sebelum dipakai kembali.
Pemurnian minyak goreng bekas ini meliputi 3 tahap proses, yaitu :
1. Penghilangan bumbu (despicing)
2. Netralisasi
3. Pemucatan (bleaching)
2.4 Sabun
Sabun adalah surfaktan yang dipakai dengan air untuk mencuci dan membersihkan.
Sabun biasanya berbentuk padatan tercetak yang disebutbatangkarena sejarah dan bentuk
umumnya. Penggunaan sabun cair juga telah telah meluas, terutama pada sarana-sarana publik.
Jika diterapkan pada suatu permukaan, air bersabun secara efektif mengikat partikel dalam
suspensi mudah dibawa oleh air bersih. Di negara berkembang, deterjen sintetik telah
menggantikan sabun sebagai alat bantu mencuci atau membersihkan.Sabun lunak adalah sabun
yang mengandung ion kalium karenadalam proses pembuatannya, basa yang dipakai adalah
kaliumhidroksida (kaustik potas). Sabun jenis ini disebut sabun lunak karenamemang kalium
hidroksida memiliki sifat pemutih (bleaching) yanglebih lunak daripada natrium hidroksida
yang dipakai pada sabunkeras. Contoh sabun lunak adalah semua produk sabun mandi,
sampo, dan pasta gigi. Proses pembuatannya melibatkan reaksi kimia berikut ini.
kalium hidroksida + gliserol tristearat => kalium stearat (sabun mandi) + gliserol
Atau
kalium hidroksida + gliserol tripalmitat => kalium palmitat (sabun mandi) + gliserol
Selain kandungan basa yang berbeda-beda, jenis dan jumlah minyak dan lemak yang
dipakai dalam pembuatan jenis sabun lunak ini juga memengaruhi sifat-sifat fisik sabun.
Sifat fisik itu meliputikeras dan lunaknya, jumlah busa yang dihasilkan, warnanya transparan
atau tidak, kelarutan dalam air, dan lain-lain.Tambahan bahan-bahan lain seperti minyak atsiri,
vitamin,mineral, parfum, pewarna, mint dan esens atau pemberi rasa pada pasta gigi, dan lainlain akan mempertinggi kegunaan dan menambah daya tarik pembersih yang termasuk ke
dalam sabun lunak ini.
Sifat-Sifat Sabun
Sifat – sifat sabun yaitu :
a) Sabun bersifat basa. Sabun adalah garam alkali dari asam lemak suku tinggi sehingga
akan dihidrolisis parsial oleh air. Karena itu larutan sabun dalam air bersifat basa.
CH3(CH2)16COONa + H2O → CH3(CH2)16COOH + NaOH
b) Sabun menghasilkan buih atau busa. Jika larutan sabun dalam air diaduk maka akan
menghasilkan buih, peristiwa ini tidak akan terjadi pada air sadah. Dalam hal ini sabun
dapat menghasilkan buih setelah garam garam Mg atau Ca dalam air mengendap.
CH3(CH2)16COONa + CaSO4 →Na2SO4 + Ca(CH3(CH2)16COO)2
c) Sabun mempunyai sifat membersihkan. Sifat ini disebabkan proses kimia koloid, sabun
(garam natrium dari asam lemak) dipakai untuk mencuci kotoran yang bersifat polar
maupun non polar, karena sabun mempunyai gugus polar dan non polar. Molekul sabun
mempunyai rantai hidrogen CH3(CH2)16 yang bertindak sebagai ekor yang bersifat
hidrofobik (tidak suka air) dan larut dalam zat organic sedangkan COONa+ sebagai
kepala yang bersifat hidrofilik (suka air) dan larut dalam air.
Kinetika Reaksi Kimia Saponifikasi
Kata saponifikasi atau saponify berarti membuat sabun (Latin sapon, = sabun dan –fy
adalah akhiran yang berarti membuat). Bangsa Romawi kuno mulai membuat sabun sejak 2300
tahun yang lalu dengan memanaskan campuran lemak hewan dengan abu kayu. Pada abad 16
dan 17 di Eropa sabun hanya dipakai dalam bidang pengobatan. Barulah menjelang abad 19
penggunaan sabun meluas. Sabun dibuat dari proses saponifikasi lemak hewan (tallow) dan
dari minyak. Gugus induk lemak disebut fattyacidsyang terdiri dari rantai hidrokarbon panjang
(C-12 sampai C18) yang berikatan membentuk gugus karboksil. Reaksi Penyabunan sbb:
Saponifikasi merupakan proses hidrolisis basa terhadap lemak dan minyak, dan reaksi
saponifikasi bukan merupakan reaksi kesetimbangan. Hasil mula-mula dari penyabunan adalah
karboksilat karena campurannya bersifat basa. Setelah campuran diasamkan, karboksilat
berubah menjadi asam karboksilat. Produknya, sabun yang terdiri dari garam asam-asam
lemak. Fungsi sabun dalam keanekaragaman cara adalah sebagai bahan pembersih. Sabun
menurunkan tegangan permukaan air, sehingga memungkinkan air untuk membasahi bahan
yang dicuci dengan lebih efektif. Sabun bertindak sebagai suatu zat pengemulsi untuk
mendispersikan minyak dan sabun teradsorpsi pada butiran kotoran.
Reaksi pembuatan sabun atau saponifikasi menghasilkan sabun sebagai produk utama
dan gliserin sebagai produk samping. Gliserin sebagai produk samping juga memiliki nilai jual.
Sabun merupakan garam yang terbentuk dari asam lemak dan alkali. Sabun dengan berat
molekul rendah akan lebih mudah larut dan memiliki struktur sabun yang lebih keras. Sabun
memiliki kelarutan yang tinggi dalam air, tetapi sabun tidak larut menjadi partikel yang lebih
kecil, melainkan larut dalam bentuk ion.Prinsip dalam proses saponifikasi, yaitu lemak akan
terhidrolisis oleh basa, menghasilkan gliserol dan sabun mentah. Proses pencampuran antara
minyak dan alkali kemudian akan membentuk suatu cairan yang mengental, yang disebut trace.
Pada campuran ini kemudian ditambahkan garam NaCl. Garam NaCl ditambahkan untuk
memisahkan antara produk sabun dan gliserol sehingga sabun akan tergumpalkan sebagai
sabun padat yang memisah dari geliserol(Gebelin,2005).
Sabun kalium(RCOOK) disebut juga sabun lunak dan umumnya dipakai untuk
sabun mandi cair, sabun cuci pakaian dan perlengkapan rumah tangga. Sedangkan sabun
natrium(RCOONa) disebut juga sabun keras dan umumnya dipakai sebagai sabun cuci,
dalam industri logam dan untuk mengatur kekerasan sabun kalium(Solomons,2004).
Sabun dibuat dari proses saponifikasi lemak hewan(tallow) dan dari minyak. Gugus
induk lemak disebut fattyacids yang terdiri dari rantai hidrokarbon panjang(C12 sampai C18)
yang berikatan membentuk gugus karboksil. Asam lemak rantai pendek jarang dipakai
karena menghasilkan sedikit busa. Reaksi saponifikasi tidak lain adalah hidrolisis basa suatu
eter dengan alkali(NaOH/KOH). Range atom C diatas mempengaruhi sifat-sifat sabun seperti
kelarutan, proses emulsi, dan pembasahan. Sabun murni terdiri dari 95% sabun aktif dan
sisanya adalah air, gliserin, garam, dan kemurnian lainnya. Semua minyak atau lemak pada
dasarnya dapat dipakai untuk membuat sabun. Lemak merupakan campuran ester yang
dibuat dari alkohol dan asam karboksilat seperti asam stearat, asam oleat, dan asam palmitat.
Lemak padat mengandung ester dari gliserol dan asam palmiat sedangkan minya, seperti
minyak zaitun mengandung ester dari gliserol asam oleat.
Sabun termasuk salah satu jenis surfaktan yang terbuat dari minyak atau lemak alami.
Surfaktan mempunyai struktur bipolar. Bagian kepala bersifat hidrolik dan bagian ekor bersifat
hidrofobik. Karena sifat inilah sabun mammpu mengangkat kotoran(biasanya lemak) dari
badan dan pakaian. Selain itu, pada larutan, surfaktan akan menggerombol membentuk misel.
Sabun juga mengandung sekitar 25% gliserin. Gliserin bisa melembabkan dan melembutkan
kulit, menyejukan dan meminyaki sel-sel kulit juga. Oleh karena itu dilakukan percobaan
pembuatan sabun dan pengujian terhadap sifat-sifat sabun, sehingga akan didapat sabun yang
berkualitas,
Sabun merupakan suatu kebutuhan pokok manusia yang selalu dipakai sehari-hari.
Fungsi utama dari sabun adalah membersihkan. Di lingkungan sekitar, banyak macam wujud
sabun yang dapat ditemui, baik yang dalam bentuk cair, lunak, krim, maupun yang padat.
Kegunannya pun beragam, ada yang sebagai sabun mandi, sabun cuci tangan, sabun cuci
peralatan rumah tangga dan lain sebagainya,
Ester karboksilat sederhana adalah senyawa netral. Molekulnya polar tapi tidak dapat
membentuk ikatan hidrogen dengan sesamanya. Senyawa ini kurang larut dalam air dan
bertitik didih lebih rendah dibandingkan asam karboksilat asalnya. Eter dapat berikatan
hidrogen dengan air. Ester yang berbobot molekul rendah sedikit larut dalam air tetapi ester
yang terdiri dari empat atau lima karbon hampir tidak dapat larut dalam air. Ester dari asam
dan alkohol yang berbobot molekul rendah dan berbau enak. Senyawa ini mudah menguap dari
buah-buahan dan berbungaan, yang mencirikan rasa atau baunya(Wilbraham,1992)
Lemak dan minyak yang umum dipakai dalam pembuatan sabun adalah trigleserida
dengan tiga buah asam lemak yang tidak beraturan diesterifikasi dengan gliserol. Masingmasing lemak mengandung sejumlah molekul asam lemak dengan rantai karbon panjang antara
C12(asam laurik) hingga C18(asam stearat) pada lemak jenuh dan begitu juga dengan lemak tak
jenuh. Campuran trigliserida diolah menjadi sabun melalui proses saponifikasi dengan larutan
natrium hidroksida membebaskan glisero(Basyinger,2004).
Jenis alkali yang umum dipakai dalam proses saponifikasi adalah NaOH, KOH,
Na2CO3, NH4OH, dan ethanolamines. NaOH, atau yang biasa dikenal dengan soda kaustik
dalam industri sabun, merupakan alkali yang paling banyak dipakai dalam pembuatan sabun
keras. KOH banyak dipakai dalam pembuatan sabun cair karena sifatnya yang mudah larut
dalam air. Na2CO3 (abu soda/natrium karbonat) merupakan alkali yang murah dan dapat
menyabunkan asam lemak, tetapi tidak dapat menyabunkan trigliserida (minyak atau lemak).
Ethanolamines merupakan golongan senyawa amin alkohol. Senyawa ini dapat
dipakai untuk membuat sabun dari asam lemak. Sabun yang dihasilkan sangat mudah larut
dalam air, mudah berbusa, dan mampu menurunkan kesadahan air. Sabun yang terbuat dari
ethanolamines dan minyak kelapa menunjukkan sifat mudah berbusa tetapi sabun ini
lebih umum dipakai sebagai sabun industri dan deterjen, bukan sebagai sabun rumah
tangga. Pencampuran alkali yang berbeda sering dilakukan oleh industri sabun dengan tujuan
untuk mendapatkan sabun dengan keunggulan tertentu.
Bahan pembuatan sabun terdiri dari dua jenis, yaitu bahan baku dan bahan pendukung.
Bahan baku dalam pembuatan sabun adalah minyak atau lemak dan senyawa alkali (basa).
Bahan pendukung dalam pembuatan sabun dipakai untuk menambah kualitas produk sabun,
baik dari nilai guna maupun dari daya tarik. Bahan pendukung yang umum dipakai dalam
proses pembuatan sabun di antaranya natrium klorida, natrium karbonat, natrium fosfat,
parfum, dan pewarna.
Bahan baku pendukung dipakai untuk membantu proses penyempurnaan sabun hasil
saponifikasi (pegendapan sabun dan pengambilan gliserin) sampai sabun menjadi produk yang
siap dipasarkan. Bahan-bahan ini adalah NaCl (garam) dan bahan-bahan aditif.
1. NaCl
NaCl merupakan komponen kunci dalam proses pembuatan sabun. Kandungan
NaCl pada produk akhir sangat kecil karena kandungan NaCl yang terlalu tinggi di dalam
sabun dapat memperkeras struktur sabun. NaCl yang dipakai umumnya berbentuk air
garam (brine) atau padatan (kristal). NaCl dipakai untuk memisahkan produk sabun dan
gliserin. Gliserin tidak mengalami pengendapan dalam brine karena kelarutannya yang
tinggi, sedangkan sabun akan mengendap. NaCl harus bebas dari besi, kalsium, dan
magnesium agar diperoleh sabun yang berkualitas.
2. Bahan aditif
Bahan aditif merupakan bahan-bahan yang ditambahkan ke dalam sabun yang
bertujuan untuk mempertinggi kualitas produk sabun sehingga menarik konsumen. Bahanbahan aditif ini antara lain : Builders, Fillersinert, Anti oksidan, Pewarna,dan parfum.
Pada Prosesnya dilakukan pencampuran KOH harus disamakan suhunya terlebih
dahulu, karena suhu merupakan salah satu faktor yang mempengaruhi laju reaksi. Jika suhu
dinaikkan maka laju reaksi semakin besar karena kalor yang diberikan akan menambah
energi kinetik partikel pereaksi, akibatnya jumlah dari energi tumbukan bertambah besar,
begitu pun sebaliknya. Larutan yang telah sama suhunya kemudian dicampurkan.
Pencampuran pada suhu yang sama agar laju reaksi yang dihasilkan tidak mengalami
perubahan besar. Untuk menentukan laju dari reaksi kimia yang diberikan, harus
ditentukan seberapa cepat perubahan konsentrasi yang terjadi pada reaktan atau produknya.
Secara umum, apabila terjadi reaksi A→B, maka mulamula zat yang A dan zat B sama
sekali belum ada. Setelah beberapa waktu, konsentrasi B akan meningkat sementara
konsentrasi zat A akan menurun. (Partana, 2003 : 47).
Hukum laju dapat ditentukan dengan melakukan serangkain eksperimen secara
sistematik pada reaksi A + B → C, untuk menentukan orde reaksi terhadap A maka konsentrasi
A dibuat tetap sementara konsentrasi B divariasi kemudian ditentukan laju reaksinya pada
variasi konsentrasi ini . Sedangkan untuk menentukan orde reaksi B, maka konsentrasi B
dibuat tetap sementara itu konsentrasi A divariasi kemudian diukur laju reaksinya pada variasi
konsentrasi ini (Partana, 2003 : 49).
Orde dari suatu reaksi menggambarkan bentuk matematika dimana hasil
perubahandapat ditunjukkan. Orde reaksi hanya dapat dihitung secara eksperimen dan hanya
dapat diramalkan jika suatu mekanisme reaksi diketahui seluruh orde reaksi yang dapat
ditentukan sebagai jumlah dari eksponen untuk masing-masing reaktan, sedangkan hanya
eksponen untuk masing-masing reaktan dikenal sebagai orde reaksi untuk komponen itu. Orde
reaksi adalah jumlah pangkat faktor konsentrasi dalam hukum laju bentuk diferensial. Pada
umumnya orde reaksi terhadap suatu zat tertentu tidak sama dengan koefisien dalam
persamaan stoikiometri reaksi ,.
Reaksi kimia adalah proses berubahnya pereaksi menjadi hasilreaksi. Proses itu ada
yang lambat dan ada yang cepat.Contohnya bensin terbakar lebih cepat dibandingkan dengan
minyak tanah. Ada reaksi yang berlangsung sangat cepat, seperti membakar dinamit yang
menghasilkan ledakan, dan yang sangat lambat adalah seperti proses berkaratnya besi.
Pembahasan tentang kecepatan (laju) reaksi disebut kinetika kimia. Dalam kinetika kimia ini
dikemukakan cara menentukan laju reaksi dan faktor apa yang mempengaruhinya
,
Cabang ilmu kimia yang khusus mempelajari tentang laju reaksi disebut kinetika kimia.
Tujuan utama kinetika kimia ialah menjelaskan bagaimana laju bergantung pada konsentrasi
reaktan dan mengetahui mekanisme suatu reaksi berdasarkan pengetahuan tentang laju reaksi
yang diperoleh dari eksperimen ,
Kinetika kimia adalah bagian dari kimia fisika yang mempelajari tentang kecepatan
reaksi-reaksi kimia dan mekanisme reaksi-reaksi ini . Tidak semua reaksi kimia dapat
dipelajari secara kinetic. Reaksi-reaksi yang berjalan sangat cepat seperti reaksi-reaksi ion atau
pembakaran dan reaksi-reaksi yang sangat lambat seperti pengkaratan, tidak dapat dipelajari
secara kinetik. Di antara kedua jenis ini, banyak reaksi-reaksi yang kecepatannya dapat diukur
Kecepatan reaksi ialah kecepatan perubahan konsentrasi pereaksi terhadap waktu
Kinetika kimia disebut juga dinamika kimia, karena adanya gerakan molekul, elemen
atau ion dalam mekanisme reaksi dan laju reaksi sebagai fungsi waktu. Mekanisme reaksi
dapat diramalkan dengan bantuan pengamatan dan pengukuran besaran termodinamika suatu
reaksi, dengan mengamati arah jalannya reaktan maupun produk suatu system
Kinetika kimia merupakan cabang ilmu kimia yang mempelajari tentang proses yang
berhubungan dengan kecepatan atau laju suatu reaksi dan faktor-faktor yang mempengaruhi
laju reaksi. Praktek suatu reaksi kimia dapat berlangsung dengan laju atau kecepatan yang
berbeda-beda
Kinetika kimia merupakan salah satu bidang dalam kimia yang mempelajari tentang
kecepatan dan laju terjadinya reaksi kimia. Kata ―kinetik‖ bermaksud perubahan atau
perubahan. Salah satu hal penting yang perlu di pelajari dalam kinetika kimia ini adalah laju
reaksi. Laju reaksi ialah perubahan konsentrasi reaktan atau produk terhadap waktu(M/s).Kita
telah tahu bahwa setiap reaksi dapat dinyatakan dengan persamaan umum
Reaktan——->Produk atau A—>B
Persamaan ini memberitahukan bahwa, selama berlangsungnya suatu reaksi, molekul
reaktan bereaksi sedangkan molekul produk terbentuk. Sebagai hasilnya, kita dapat kita dapat
mengamati jalannya reaksi dengan cara memantau menurunnya konsentrasi reaktan atau
meningkatnya konsentrasi produk.
Secara umum akan lebih mudah apabila kita menyatakan laju dalam perubahan
konsentrasi terhadap waktu. Jadi, untuk reaksi diatas kita dapat menyatakan laju reaksi sebagai
laju = -(Δ[A] / Δt) atau laju = -(Δ[B] / Δt)
dengan Δ[A] dan Δ[B] adalah perubahan konsentrasi (M) selama waktu t. Karena konsentrasi
A menurun selama selang waktu ini , Δ[A] merupakan kuantitas negatif karena terus
berkurang. Laju reaksi ialah kuantitas positif, oleh karena itu diperlukan tanda negatif,
sebaliknya Δ[B] akan terus bertambah maka tidak perlu ditambah tanda negatif.
Untuk reaksi yang lebih rumit, kita harus hati hati dalam menuliskan rumus laju.
Misalnya pada persamaan reaksi : 2A—->B
Dalam reaksi ini , 2 mol A menghilang setiap terbentuk 1 mol B. Dalam kasus
seperti ini kita harus menuliskan lajunya sebagai
laju = -(1/2)(Δ[A] / Δt) atau laju = -(Δ[B] / Δt)
dan untuk reaksi aA + bB —> cC + dD mak lajunya
Laju =-(1/a)(Δ[A] / Δt)= -(1/b)(Δ[B] / Δt) = (1/c)(Δ[C] / Δt) = (1/d)(Δ[B] / Δt)
(bisakimia.com, 2013)
Kinetika reaksi merupakan cabang ilmu kimia yang membahas tentang laju reaksi
danfaktor-faktor yang mempengaruhi. Laju (kecepatan) reaksi dinyatakan sebagai perubahan
konsentrasi pereaksi atau hasil reaksi terhadap satuan waktu. Laju rekasi suatu reaksi kimia
dapat dinyatakan dengan persamaan laju reaksi. Untuk reaksi berikut:
A + B —> AB
Persamaan laju reaksi secara umum ditulis sebagai berikut:
R = k [A]m [B]n
K sebagai konstanta laju reaksi, m dan n orde parsial masing-masing pereaksi (Petrucci,
1987).
Laju atau kecepatan mengacu pada sesuatu yang terjadi dalam satu satuan waktu.
Reaksi, laju reaksi yang mendeskripsikan seberapa cepat konsentrasi reaktan atau produk
berubah dengan waktu ).
Laju reaksi didefinisikan sebagai perubahan konsentrasi persatuan waktu. Satuan yang
umum adalah mol/dm-3-i . Umumnya laju reaksi meningkat dengan meningkatnya konsentrasi
dan dapat dinyatakan sebagai
Laju = k f (C1, C2, …., Ci)
Di mana k adalah konstanta laju, juga disebut konstanta laju spesifik atau konstanta kecepaan,
C1, C2, … adalah konsentrasi dari reaktan-reakan dan produk-produk (Dogra, 1990).
Laju reaksi kimia terlihat dari perubahan konsentrasi molekul reaktan atau konsentrasi
molekul produk terhadap waktu. Laju reaksi tidak tetap melainkan berubah terus-menerus
seiring dengan perubahan konsentrasi.
Pengetahuan tentang faktor yang mempengaruhi laju reaksi berguna dalam mengontrol
kecepatan reaksi berlangsung cepat, seperti pembuatan amoniak dari nitrogen dan hidrogen,
atau dalam pabrik menghasilkan zat tertentu. Akan tetapi kadangkala kita ingin memperlambat
laju reaksi, seperti mengatasi berkaratnya besi, memperlambat pembusukan makanan oleh
bakteri, dan sebagainya
Berikut ini adalah factor-faktor yang mempengaruhi laju reaksi:
Konsentrasi
Kecepatan reaksi bergantung pada banyak factor. Konsentrasi reaktan memainkan
peran penting dalam mempercepat atau memperlambat rekasi tertentu. Konsentrasi
mempengaruhi laju reaksi karena banyaknya partikel memungkinkan lebih banyak
tumbukan, dan itu membuka peluang semakin banyak tumbukan efektif yang menghasilkan
perubahan.
Suhu
Kenaikan suhu dapat mempercepat laju reaksi karena dengan naiknya suhu,
energykinetic partikel zat-zat meningkat sehinga memungkinkan semakin banyaknya
tumbukan efektif yang menghasilkan perubahan. Berdasarkan teori tumbukan, reaksi
terjadi bila molekul bertumbukan dengan energy yang cukup besar, disebut energyaktivasi.
Laju suatu reaksi kimia bertambah dengan naiknya temperatur. Biasanya kenaikan
sebesar 10ºC akan melipatkan dua atau tiga laju suatu reaksi antara molekul-molekul.
Kenaikan laju reaksi ini dapat diterangkan sebagian sebagai lebih cepatnya molekulmolekul bergerak kian kemari pada temperatur yang lebih tinggi dan karenanya
bertabrakan satu sama lain lebih sering. Tetapi, ini belum menjelaskan seluruhnya, ke
molekul-molekul lebih sering bertabrakan, tetapi mereka juga bertabrakan dengan dampak
(benturan) yang lebih besar, karena mereka bergerak lebih cepat. Pada temperatur besar,
karena makin banyak molekul yang memiliki kecepatan lebih besar dan karenanya
memiliki energi cukup untuk bereaksi.
Hampir semua reaksi menjadi lebih cepat bila suhu dinaikkan karena kalor yang
diberikan akan menambah energi kinetik partikelpereaksi. Akibatnya jumlah dan energi
tumbukan bertambah besar ,
Untuk memutus ikatan dan mengawali reaksi, konsatanta laju dan energyaktivasi
dihubungkan oleh persamaan Arrhenius.
k = AeEa/RT
keterangan:
Ea =energyaktivasi
T = suhu mutlak
A = frekuensi tumbukan
Luas Permuaan, Sifat Dan Ukuran Pereaksi
Luas permukaan mempercepat laju reaksi karena semakin luas permukaan zat,
semakin banyak bagian zat yang saling bertumbukan dan semakin besar peluang adanya
tumbukan efektif menghasilkan perubahan.Semakin luas permukaan zat, semakin kecil
ukuran partikel zat, reaksi pun akan semakin cepat
Sifat pereaksi dan ukuran pereaksi menentukan laju reaksi. Semakin relatif dari sifat
pereaksi laju reaksi akan semakin bertambah atau reaksi berlangsung semakin cepat.
Semakin luas permukaan zat pereaksi laju reaksi akan semakin bertambah, hal ini
dijelaskan dengan semakin luas permukaan zat yang bereaksi maka daerah interaksi zat
pereaksi semakin luas juga. Permukaan zat pereaksi dapat diperluas dengan memperkecil
ukuran pereaksi. Jadi untuk meningkatkan laju reaksi, pada zat pereaksi dalam bentuk
serbuk lebih baik bila dibandingkan dalam bentuk bongkahan.
Sifat dasar pereaksi. Zat-zat berbeda secara nyata dalam lajunya mereka mengalami
perubahan kimia. Molekul hidrogen dan flour bereaksi secara meledak, bahkan pada
temperatur kamar, dengan menghasilkan molekul hidrogen fluorida.
H2 + F2 → 2HF (sangat cepat pada temperatur kamar)
Pada kondisi serupa, molekul hidrogen dan oksigen bereaksi begitu lambat sehingga tak
Nampak perubahan kimia :
2H2 + O2 → H2O
Katalis
Katalis ialah zat yang mengambil bagian dalamn reaksi kimia dan mempercepatnya,
tetapi ia sendiri tidak mengalami perubahan kimia yang permanen.. Katalis biasanya ikut
bereaksi sementara dan kemudian terbentuk kembali sebagai zat bebas. Suatu reaksi
menggunakan katalis disebut dengan reaksi katalis atau prosesnya disebut katalisme. Jadi,
katalis tidak muncul dalam laju persamaan kimia balans secara keseluruhan, tetapi
kehadirannya sangat mempengaruhi hukum laju, memodifikasi dan mempercepat lintasan
yang ada.Katalis menimbulkan efek yang nyata pada laju reaksi, meskipun dengan jumlah
yang sangat sedikit. Dalam kimia industry, banyak upaya untuk menemukan katalis yang
akan mempercepat reaksi tertentu tanpa meningkatkan timbulnya produk yang tidak
diinginkan
Sifat katalis :
1. Katalis tidak bereaksi secara permanen, karena tidak mengalami perubahan
kimia selama reaksi.
2. Katalis tidak mempengaruhi hasil akhir reaksi.
3. Katalis tidak memulai reaksi tapi hanya mempengaruhi lajunya.
4. Katalis bekerja efektif pada suhu optimum.
5. Suatu katalis hanya mempengaruhi laju reaksi spesifik, berarti katalis bekerja
pada satu reaksi atau sejenis reaksi dan tidak untuk reaksi jenis lain.
6. Keaktifan katalis dapat diperbesar zat lain yang disebutpromoter.
7. Hasil suatu reaksi kadang-kadang dapat bertindak sebagai katalis dan disebut
autokatalis.
8. Katalis dapat bereaksi dengan zat lain sehingga sifat katalisnya hilang.
9. Katalis yang dapat memperlambat reaksi disebut katalis negative (Sunarya,
2002).
Penggolongan Katalis :
Berdasarkan fasanya dapat dibedakan menjadi 2 yaitu katalis homogen dan
katalis heterogen.
1. Katalis homogen adalah katalis yang mempuyai fasa yang sama dengan
pereaksi, mungkin gas, cair dan padat.
2. Katalis heterogen adalah katalis yang mempunyai fasa yang berbeda dengan
pereaksi. Umumnya zat katalis ini berupa zat padat dan pereaksinya cair atau
gas .
Efek pelarut
Pengaruh pelarut terhadap laju penguraian obat merupakan suatu topic
terpenting untuk ahli farmasi. Walau efek-efek ini rumit dan generalisasi tidak
dapat dilaksanakan. Tampak reaksi nonelektrolik dihubungkan dengan tekanan dalam
relative atau parameter kelarutan dari pelarut dan zat terlarut. (Martin, 1993)
Orde reaksi dapat ditentukan dengan beberapa metode,
1. Metode substansi. Data yang terkumpul dari hasil pengamatan jalannya suatu
reaksi disubtitusikan ke dalam bentuk integral dari persamaan berbagai orde reaksi.
Jika persamaan itu menghasilkan menghasilkan harga K yang tetap konstan dalam
batas-batas variasi percobaan, maka reaksi dianggap berjalan sesuai dengan orde
ini .
2. Metode grafik. Plot data dalam bentuk grafik dapat dipakai untuk mengetahui
orde reaksi ini . Jika konsentrasi diplot terhadap t dan didapatkan garis lurus,
reaksi adalah orde nol. Reaksi dikatakan orde pertama bila log (a-x) terhadap t
menghasilkan garis lurus. Suatu reaksi orde-kedua akan memberikan garis lurus
bila 1/(a-x) diplot terhadap t (jika konsentrasi mula-mula sama). Jika plot 1/(a-x)2
terhadap t menghasilkan garis lurus dengan seluruh reaktan sama konsentrasi
mula-mulanya, reaksi adalah orde-ketiga.
3. Metode waktu-paruh. Dal reaksi orde, waktu paruh sebanding dengan konsentrasi
awal a, waktu paruh reaksi orde-pertama tidak bergantung pada a, waktu paruh
untuk reaksi orde-kedua, dimana a=b sebanding dengan 1/a dari dalam reaksi orde
ketiga, dimana a=b=c, sebanding dengan 1/a2
. Waktu paruh adalah
waktu yang dibutuhkan oleh suatu obat untuk terurai setengahnya dari konsentrasi
mula-mula. Obat yang sama dapat menunjukkan orde penguraian yang berbeda
pada konsidi yang berbeda. Walaupun penguraian hidrogen peroksida, misalnya
dengan katalis ion iodine adalah sau orde pertama, telah ditemukan bahwa
penguraian larutan yang distabilkan dengan berbagai pereaksi dapat menjadi ordenol. Dalam hal ini, di mana reaksi tidak tergantung pada konsentrasi obat,
penguraia mungkin akibat kontak dengan dinding wadah atau berbagai faktor luar
lainnya
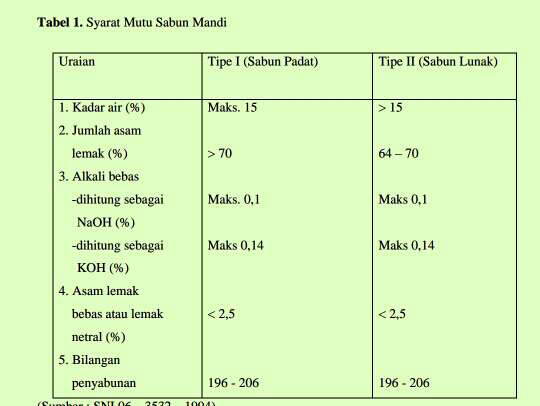
1. Semakin lama waktu pengadukan dan semakin banyak jumlah KOH yang
ditambahkan, maka semakin banyak pula jumlah sabun lunak yang dihasilkan.
2. Dalam waktu pengadukan selama 50 menit, kadar air terkecil diperoleh sebesar
5,165% dengan penambahan KOH sebanyak 15 mL dan kadar air tebesar diperoleh
sebesar 68,4525% dengan penambahan KOH sebanyak 30 mL.
3. Dalam waktu pengadukan selama 30 menit, diperoleh kadar alkali bebas pada sabun
lunak sebesar 0,0118% dengan penambahan KOH sebanyak 15 mL. Sementara
dalam waktu pengadukan selama 40 menit, diperoleh kadar alkali bebas pada sabun
lunak sebesar 0,0457% dengan penambahan KOH sebanyak 30 mL.
4. Semakin sedikit jumlah KOH dan waktu pengadukan, maka tingkat kekeruhan
minyak mineral dalam sabun lunak juga akan berkurang.
5. Semakin banyak jumlah KOH serta semakin lama waktu pengadukan, maka nilai
pH yang ada dalam sabun lunak akan semakin meningkat
6. Hasil penelitian yang diperoleh dari pembuatan sabun lunak berdasarkan
penambahan jumlah KOH dan lama waktu pengadukan, didapat tetapan laju
reaksinya (k) yaitu 1,5506 dengan –rA = 1,5506 [A] [6,416A]1,9025
Dalam penyempurnaan pembuatan sabun lunak dari minyak goreng bekas ini masih
dibutuhkan beberapa penelitian lanjutan. Sehingga diharapkan bagi peneliti selanjutnya untuk
tetap mengutamakan keamanan dalam melakukan eksperimen lanjutan dari penelitian ini,
mengingat KOH adalah basa kuat dan bersifat korosif.
Selain itu diharapkan bagi peneliti selanjutnya untuk mengembangkan penggunaan
minyak goreng bekas agar dapat dipakai sebagai produk baru yang lebih bermanfaat lagi.








.jpg)



